相关赛道: 医疗器械生物制药医用耗材
动脉橙周报20201108:三叶草生物获3.28亿美元追加投资,远大医药COVID-19疫苗获得FDA批准进行I期临床试验
2020.11.08 来源: 动脉网 热度: 546

作品 | 《愚蠢的治疗》
作者 | 让·桑德斯·赫摩森
图说医疗史 | 20201108期
流式细胞仪开发商Cytek Biosciences完成1.2亿美元D轮融资2020年11月5日获悉,流式细胞仪开发商Cytek Biosciences已完成1.2亿美元D轮融资,本轮融资由RA Capital和Hillhouse Capital领投,OrbiMed和Lyfe Capital跟投。公司表示将利用这笔资金扩大其全球基础设施,以及扩大其在免疫治疗、免疫肿瘤和传染病等领域的细胞分析市场。2020年11月5日获悉,杭州瑞彼加医疗科技有限公司(瑞彼加/Rebeccatech)已于今年初完成数千万元A轮融资,由启赋资本独家投资。据了解,瑞彼加专注于探索精准控制的微机电射频技术在临床疾控和康复、美容等方面的应用。截至目前,基于公司自主研发的生物兼容微机电技术,瑞彼加已研发出针对各个专科应用领域的未来设备,包括泌尿外科,肝病学科,以及针对皮肤的子品牌瑞彼佳NEBULYFT微射频美容仪。医疗设备公司WishBone Medical完成2000万美元股权融资2020年11月5日获悉,小儿骨科医疗设备制造商WishBone Medical, Inc.已完成2000万美元股权融资,本轮融资由LKCM Headwater Investments全额出资,LKCM Headwater Investments是Luther King Capital Management的私募股权投资部门。公司将利用所得资金支持商业扩张、开发新产品系统和资助其他运营计划。2020年11月3日获悉,杭州安杰思医学科技股份有限公司IPO首发获通过,此次IPO保荐机构为中信证券,会计师事务所为天健,律师事务所为北京德恒。本次发行股票数量不超过1447万股,且占发行后总股本的比例不低于 25%,本次发行不涉及股东公开发售。此次IPO拟募资3.88亿元,用于年产1000万件医用内窥镜设备及器械项目、营销服务网络升级建设项目和微创医疗器械研发中心项目。2020年11月3日获悉,杭州安旭生物科技股份有限公司IPO首发获通过,此次IPO保荐机构为民生证券,会计师事务所为信永中和,律师事务所为锦天城。本次发行股票数量不超过1533.34万股,占发行后总股本的比例不低于25.00%,均为公开发行新股,公司股东不公开发售股份。此次IPO拟募资4.59亿元,用于年产3亿件第二、第三类医疗器械、体外诊断试剂、仪器和配套产品建设项目、体外诊断试剂及POCT仪器生产智能化技术改造项目、技术研发中心升级建设项目、营销与服务网络体系建设项目和补充流动资金。2020年11月3日获悉,苏州艾隆科技股份有限公司IPO首发获通过,此次IPO保荐机构为海通证券,会计师事务所为立信,律师事务所为观韬中茂。公司首次公开发行股票数量不超过1930万股,全部为新股发行,原股东不公开发售股份,本次公开发行股票数量占发行后公司总股本的比例不低于25%。此次IPO拟募资4.77亿元,用于药房自动化设备生产基地项目、研发中心项目、营销及售后一体化建设项目和补充流动资金。道尔生物完成近亿元A+轮融资,专注研发创新蛋白药物2020年11月3日获悉,浙江道尔生物科技有限公司(道尔生物)完成近亿元A+轮融资。该轮融资由华睿投资、海越资管及老股东凯泰资本、杭州佰锐共同完成。本次所募集资金将用于推动公司的3个一类创新药的临床申报以及后续管线的研发和临床前研究。三叶草生物获CEPI追加投资,总额达3.28亿美元2020年11月3日,四川三叶草生物消息,流行病防范创新联盟(CEPI)追加投资支持三叶草生物新冠疫苗候选物研发。包括此前投资,总额将高达3.28亿美元。据了解,此前CEPI已向三叶草生物提供了6950万美元,三叶草生物是其全球第九个共同开发新冠病毒疫苗的合作。柳叶刀机器人完成数千万元天使轮融资,助力骨科手术机器人产业化2020年11月3日,柳叶刀机器人公司完成数千万元天使轮融资,投资方为元生创投和前海母基金。本轮融资将用于关节置换手术机器人产品的临床注册和智能化手术解决方案的研发。生物制药公司Opthea完成1.282亿美元IPO,为III期临床试验提供资金2020年11月3日,生物制药公司Opthea Ltd.在美国纳斯达克市场完成了1.282亿美元IPO,将为湿性年龄相关性黄斑变性(AMD)的两项III期试验提供资金,并在成功的情况下将该公司的主要候选药物OPT-302推向市场。OPT-302是一种可溶性的血管内皮生长因子受体3(VEGFR-3)。2020年11月2日获悉,动物蛋白药研发商“伟杰信生物”近日完成过亿元B轮融资。本轮融资由国投创业领投,北京首发展天玑创业投资基金和丰川资本共同参与,行远致同担任首席财务顾问。融资所募集资金将用于推进在研品种的临床试验,并加快浙江生产基地建设和组建市场营销团队,完成公司由研发向产销全产业链的构建。美国运动可穿戴设备公司“WHOOP”获1亿美元E轮融资2020年11月2日,据媒体报道,美国运动可穿戴设备公司“WHOOP”完成1亿美元E轮融资,由Institutional Venture Partners领投,估值达12亿美元。本轮融资其他参与的投资者包括SoftBank Vision Fund 2、Accomplice等。本轮融资获得的资金,公司将用于产品和软件开发、全球扩张以及会员服务。国家卫健委发布《关于印发流行性感冒诊疗方案(2020年版)的通知》2020年11月4日,国家卫健委官方网站发布《关于印发流行性感冒诊疗方案(2020年版)的通知》。在医院感染控制措施方面,流行性感冒诊疗方案(2020年版)提到:(一)落实门急诊预检分诊制度,做好患者分流。(二)医疗机构应当分开安置流感疑似和确诊患者,患者外出检查、转科或转院途中应当佩戴医用外科口罩。(三)加强病房通风,并做好诊室、病房、办公室和值班室等区域物体表面的清洁和消毒。(四)按照要求处理医疗废物,患者转出或离院后进行终末消毒。(五)医务人员按照标准预防原则,根据暴露风险进行适当的个人防护。河北省医保局发布《河北省治理高值医用耗材改革实施方案》2020年11月4日获悉,河北省医保局官网发布了《河北省治理高值医用耗材改革实施方案》。《实施方案》要求强化流通管理,提升高值医用耗材流通领域规模化、专业化、信息化水平。落实由生产企业选择配送企业制度。规范购销合同管理,医疗机构要严格依据合同完成回款。鼓励各地结合实际通过“两票制”等方式减少高值医用耗材流通环节,规范配送管理,净化流通环境,推动购销行为公开透明。将高值医用耗材相关企业及其从业人员诚信经营和执业情况纳入信用管理体系,加强对失信行为的记录、公示和预警,强化履约管理。国家医保局发布《国家医疗保障局关于积极推进“互联网+”医疗服务医保支付工作的指导意见》2020年11月2日,国家医保局发布《国家医疗保障局关于积极推进“互联网+”医疗服务医保支付工作的指导意见》,指出定点医疗机构提供符合规定的“互联网+”医疗复诊服务,按照公立医院普通门诊诊察类项目价格收费和支付。发生的药品费用比照线下医保规定的支付标准和政策支付。《指导意见》明确了参保人在本统筹地区“互联网+”医疗服务定点医疗机构复诊并开具处方发生的诊察费和药品费,可以按照统筹地区医保规定支付,支持“互联网+”医疗复诊处方流转。2020年11月5日, 拜耳与北京经济技术开发区在第三届中国国际进口博览会签署合作意向书。根据意向,拜耳将投入超过5000万欧元(折合人民币超过4亿元),用以大幅提升处方药北京工厂产能,保证拜耳高品质处方药产品的稳定供应。此次产能提升项目包含生产区以及配套技术区,将配备新的全自动高速生产线及配套的全自动物流系统。该项目预计将于2022年底投入使用。生命科学公司Cytiva与锦波生物签署战略合作协议,共同打造“人源化胶原蛋白新材料联合实验室“2020年11月5日,生命科学公司Cytiva宣布与锦波生物签署战略合作协议,双方将共同打造“人源化胶原蛋白新材料联合实验室“。Cytiva的产品与技术可进一步助力锦波生物将人源III型胶原蛋白实现大规模产业化,打造全球规模最大的功能蛋白产业基地。2020年11月5日,在第三届中国国际进口博览会上,生命科学公司Cytiva与智飞生物达成战略合作。此次签署的战略合作协议,旨在进一步深化与Cytiva的合作,由供应关系升级为全面战略合作伙伴关系。双方后续将在生产设备研发、物料供应、售后服务、人员培训交流及项目研发方面展开全方位合作。Cytiva的产品技术和服务将进一步助力智飞生物布局人用疫苗、人用治疗性抗体和细胞治疗等众多研发管线加速申报临床,早日实现商业化生产,造福更多患者。生物技术公司Fluidigm与Healthvana达成合作,通过数字平台提供COVID-19检测结果2020年11月5日,生物技术工具供应商Fluidigm宣布与COVID-19检测结果交付平台Healthvana Inc.达成合作,为使用基于Fluidigm®唾液的Advanta™ Dx SARS-CoV-2 RT-PCR检测的临床实验室客户提供通过Healthvana的移动平台更快地交付检测结果的选择。2020年11月1日,启德医药(GeneQuantum Healthcare)与三星生物(Samsung Biologics)达成了战略合作,双方将会共同开发启德医药的ADC在研药GQ1003(靶向TROP2)。据悉,本次协议也透露出三星生物正在加速进入中国市场。2020年3月,三星生物与中国台湾新旭生技公司缔结关于后者阿兹海默症新药CDO合同(生产工艺技术开发服务)。2020年11月2日获悉,仁东医学科技有限公司和阿斯利康(无锡)贸易有限公司前列腺癌精准诊断战略合作启动仪式在郑州盛大召开,标志着国内第一个在前列腺癌领域探索伴随诊断开发和共同商业化模式的战略合作的正式启动。此次合作包含前列腺癌同源重组修复缺陷基因(HRR)检测产品的共同开发、申报注册,前列腺癌精准诊疗的学术推广以及针对前列腺癌基因检测的患者援助,辅助医生更精准地制定临床治疗方案,让患者获得准确合规的诊断,从而推动肿瘤精准诊疗的实践和落地。精准医疗公司Tempus与杨森制药达成合作,应用数据科学提升治疗开发水平2020年11月2日,人工智能和精准医疗领域公司Tempus宣布与Janssen Research & Development , LLC达成战略合作,Tempus将与专注于肿瘤临床开发项目的杨森数据科学家和肿瘤学家密切合作。此次合作是多年数据协议的一部分,该协议正在促进预测性人工智能/机器学习项目,以及杨森参与Tempus的TIME Trial®网络,以加速选定的生物标志物驱动试验的患者注册。医疗器械公司Intuitive Surgical达芬奇SP手术系统首次亮相中国2020年11月5日,在2020第三届中国国际进口博览会上,医疗器械公司Intuitive Surgical(直观医疗)单孔手术平台—达芬奇SP手术系统首次亮相中国。达芬奇SP系统为外科医生提供了机器人辅助技术,这种技术专为通过狭深入路到达人体深处组织而设计。通过单个小切口入路,有助于外科医生完成更复杂的手术。达芬奇SP系统包括三把多关节可转腕的器械和首个达芬奇全转腕的三维高清摄像头。通过单个SP机械臂,器械和摄像头均穿过同一个套管进入体内,并实现灵活的单孔入路定位。2020年11月5日获悉,联环药业公布,公司收到国家药品监督管理局核准签发的硫酸氢氯吡格雷片《药品注册证书》(受理号:CYHS1800400国)。硫酸氢氯吡格雷片是一种血小板聚集抑制剂,用于缺血性中风、急性心肌梗死等。此次公司获得硫酸氢氯吡格雷片《药品注册证书》,进一步丰富了公司的产品线,有助于提升公司产品的市场竞争力。优时比公布新型抗炎药bimekizumab治疗中重度斑块型银屑病成人患者III期临床研究结果2020年11月5日获悉,优时比(UCB)公布了评估新型抗炎药bimekizumab治疗中度至重度斑块型银屑病成人患者3期临床研究BE SURE的详细结果。数据显示,与艾伯维Humira相比,接受bimekizumab治疗的患者皮损清除率更高。bimekizumab是一种具有双重作用机制的独特分子,可同时强效、选择性地中和IL-17A和IL-17F,这是驱动炎症过程的2种关键细胞因子。基因编辑公司CRISPR与Vertex公布CRISPR基因编辑疗法最新临床结果2020年11月5日,基因编辑公司CRISPR Therapeutics和Vertex Pharmaceuticals宣布,双方共同开发的CRISPR/Cas9基因编辑疗法CTX001的1/2期临床试验数据,已被美国血液学会(ASH)年会接受,将在全体科学会议作为口头报告公布。CTX001是一种在研自体CRISPR/Cas9基因编辑疗法。通过在体外对患者的造血干细胞进行改造,使红细胞中产生高水平的胎儿血红蛋白(HbF)。2020年11月4日获悉,美康生物发布公告称,公司取得由浙江省药品监督管理局颁发的《中华人民共和国医疗器械注册证(体外诊断试剂)》。获得该注册证的产品是:“雌二醇检测试剂盒(化学发光免疫分析法)”,其适用范围:本试剂盒用于体外定量测定人血清和血浆中雌二醇浓度。注册证有限期自2020年10月28日至2025年10月27日。2020年11月4日获悉,凯利泰公布,获得国家药品监督管理局颁发的椎体后凸成形系统Ⅲ类《医疗器械注册证》(国械注准20203040763号)。该产品经审查,符合医疗器械市场准入规定,准许注册,有效期至二O二五年九月二十二日。公司取得上述产品的Ⅲ类《医疗器械注册证》,进一步完善了公司微创介入领域产品线,增强了公司的核心竞争力。2020年11月4日获悉,万泰生物公告,公司的新型冠状病毒(2019-nCoV)抗原检测试剂盒(胶体金法)获得欧盟CE认证,可在欧盟国家和认可欧盟CE认证的国家销售。凯普生物子公司取得“CYP2C9、VKORC1基因多态性检测试剂盒”医疗器械注册证2020年11月4日,凯普生物公布,公司全资子公司广州凯普医药科技有限公司近日取得国家药品监督管理局颁发的“CYP2C9、VKORC1基因多态性检测试剂盒”《中华人民共和国医疗器械注册证(体外诊断试剂)》。上述产品注册证的取得,满足市场多样化的需求,进一步丰富了公司的产品种类,提升公司的核心竞争力,符合公司“核酸99”的战略规划,将对公司未来的经营发展产生积极影响。东方生物自主研发的新冠、腺病毒等四联检试剂盒获准出口2020年11月4日,东方生物官微称,今年10月底,公司自主研发的“甲乙型流感/新型冠状病毒/呼吸道合胞病毒/腺病毒抗原联合检测试纸”入选商务部《取得国外标准认证或注册的医疗物资生产企业清单》。联拓生物宣布Infigratinib治疗局部晚期或转移性不可切除胆管癌患者III期PROOF临床试验获CDE批准2020年11月4日,联拓生物宣布获得中国国家药品监督管理局药品审评中心(CDE)关于Infigratinib的3期PROOF临床试验批件。Infigratinib是一种潜在的用于治疗伴有FGFR2基因融合的局部晚期或转移性不可切除胆管癌患者的一线治疗方式。Infigratinib是一种在研的创新型、口服、成纤维细胞生长因子受体(FGFR)1-3选择性强效抑制剂,具有明确的新型化学结构及药理作用。美康生物子公司“全自动生化分析仪”获医疗器械注册证2020年11月3日,美康生物发布公告,公司全资子公司宁波美康盛德生物科技有限公司,于近日取得了由浙江省药品监督管理局颁发的《中华人民共和国医疗器械注册证》,产品名称为“全自动生化分析仪(MS-L8080、MS-L8060、MS-L8000、MS-L7280)”。MS-L8080全自动生化分析仪是一款最多由4个单模块生化仪联机组成的高通量生化分析系统,可精准配套美康自产试剂进行高通量、高准确性检测,在提高生化分析检测效率的同时能够更好地满足市场的多元化需求,为公司国内销售平台与渠道提供更多产品;有利于提高公司的核心竞争力和市场拓展能力。赛诺菲与阿斯利康联合开发的1类单抗新药nirsevimab在华获批临床2020年11月3日,CDE官网最新公示显示,阿斯利康提交的1类新药nirsevimab注射液获得一项临床默示许可,拟定适应症为预防呼吸道合胞病毒引起的下呼吸道疾病。该药是赛诺菲和阿斯利康共同开发的一款靶向呼吸道合胞病毒的单克隆抗体,具有延长的半衰期,拟开发用于预防呼吸道合胞病毒感染。云顶新耀旗下TrodelvyTM治疗转移性三阴性乳腺癌IIb期注册临床试验首例患者给药完成2020年11月3日,云顶新耀宣布,在中国开展的TrodelvyTM(sacituzumabgovitecan,IMMU-132)用于治疗接受过至少两线既往治疗的转移性三阴性乳腺癌(mTNBC)的2b期注册临床试验EVER-132-001完成首例患者给药。EVER-132-001是一项单臂、多中心的2b期注册临床试验,其研究目的旨在在接受过至少两线既往标准化疗方案的mTNBC的中国患者中评估TrodelvyTM的有效性和安全性,将在中国招募约80名mTNBC患者。康方生物发布新型肿瘤免疫治疗新药Cadonilimab阶段性临床数据2020年11月3日,康方生物公布,公司核心自主研发的、全球首创的新型肿瘤免疫治疗新药Cadonilimab(PD-1/CTLA-4双特异性抗体,研发代号:AK104)用于经标准治疗后的复发或转移性宫颈鳞癌的阶段性数据已在2020中国肿瘤免疫治疗会议上发布。Cadonilimab用于经标准治疗后的复发或转移性宫颈鳞癌的阶段性数据的客观缓解率(ORR)为47.6%,与已经公布研究数据的PD-1单药或PD-1和CTLA-4联合用药相比,在疗效上有显着提升。生物制药公司Samsung Biologics开设美国首家CDO研发中心2020年11月2日获悉,生物制药公司Samsung Biologics首个美国CDO(合同开发组织)研发中心在旧金山成立,从而能为全球客户提供CDO服务。Samsung Biologics选择将该地区作为第一个海外扩展地,帮助其为生物产业集群地带的客户提供一站式服务。罗氏抗流感病毒新药Xofluza获CDE纳入拟优先审评2020年11月2日,CDE官网公示,罗氏进口化学创新药玛巴洛沙韦片(英文商品名:Xofluza)上市申请被纳入拟优先审评。这是一款“first-in-class”的创新药,是近20年来美国FDA批准的第一款具有新型作用机制的抗流感病毒单剂量口服药物。Xofluza服用一次即可见效,可治疗对奥司他韦耐药的病毒株和禽流感病毒株(H7N9,H5N1)。康方生物发布PD-1/VEGF双特异性抗体Ia期临床数据2020年11月2日,在北京举办的2020中国肿瘤免疫治疗会议上,康方生物发布了其自主研发的PD-1/VEGF双特异性抗体(AK112)最新的Ia期剂量爬坡临床研究初步喜人数据,研究显示AK112针对PD-1不敏感型实体瘤患者效果良好。博晖创新子公司研发的人凝血酶原复合物获药品注册证书2020年11月2日,博晖创新公告,公司控股子公司广东卫伦生物制药有限公司(广东卫伦)研发的药品人凝血酶原复合物于近日收到国家药品监督管理局核准签发《药品注册证书》。人凝血酶原复合物主要用于治疗先天性和获得性凝血因子Ⅱ、Ⅶ、Ⅸ、Ⅹ缺乏症(单独或联合缺乏)包括:凝血因子Ⅸ缺乏症(乙型血友病),以及Ⅱ、Ⅶ、Ⅹ凝血因子缺乏症等。迪瑞医疗获得“一种容器的自动条码扫描装置”发明专利证书2020年11月2日获悉,迪瑞医疗公告,近日收到由中华人民共和国国家知识产权局颁发的1项《发明专利证书》,具体情况如下:该发明名称为一种容器的自动条码扫描装置(证书号:第4025931号,专利号为ZL201810247386.4)。该专利为公司自主研发,已应用于公司集约化实验室产品线中,能够简化装置整体结构,减少故障点,提高了工作效率。该发明专利的取得不会对公司近期生产经营产生重大影响,但有利于发挥公司自主知识产权技术优势,完善知识产权保护体系,从而增强公司核心竞争力。2020年11月1日,癌症早筛领军企业康立明生物宣布启动10万人肠癌早筛多中心研究项目。该多中心研究项目“中国体检人群结直肠癌早期筛查项目——SDC2基因甲基化技术筛查结直肠癌应用多中心研究”由中国健康促进基金会、中华医学会健康管理学分会共同组织开展,旨在更好的推动在健康管理(体检)机构中规范有序开展结直肠癌的早期筛查和预防,建立中国结直肠癌筛查数据库,形成适应国情的结直肠癌筛查专家共识。诺华CAR-T疗法CTL019全球III期临床成功入组首位中国受试者2020年11月1日获悉,诺华公司(Novartis)宣布,其突破性CAR-T疗法CTL019(tisagenlecleucel, Kymriah)继去年在中国获批临床试验之后,已在2020年9月成功入组第一位中国受试者。Kymriah是一种CD19嵌合抗原受体T细胞(CAR-T)免疫疗法,是全球首款获批的CAR-T疗法。生物制药公司Insmed旗下Arikayce在欧盟获批2020年10月31日获悉,生物制药公司Insmed旗下Arikayce(阿米卡星脂质体吸入悬液)获欧盟委员会(EC)批准,用于治疗选择有限且无囊性纤维化的成人患者,治疗由鸟型分枝杆菌(MAC)导致的非结核分枝杆菌(NTM)肺部感染。Arikayce是一种新型的、每日一次的、吸入用阿米卡星制剂。FDA授予基因治疗公司LogicBio Therapeutics治疗甲基丙二酸血症候选药物LB-001快速通道指定2020年11月4日,通过开创性的靶向递送平台扩大基因医学覆盖面的公司LogicBio Therapeutics宣布,美国食品药品监督管理局(FDA)已授予其治疗甲基丙二酸血症(MMA)的临床候选药物LB-001快速通道指定。根据FDA的说法,快速通道指定的目的是通过促进治疗严重疾病和填补未被满足的医疗需求药物的开发和加速审查,使重要的新药更早地到达患者手中。生物制药公司XNK Therapeutics宣布治疗多发性骨髓瘤候选药物获得FDA孤儿药认定2020年11月4日,生物制药公司XNK Therapeutics AB宣布其治疗多发性骨髓瘤(MM)的候选研究药物已获得美国食品药品监督管理局(FDA)的孤儿药认定(ODD)。该公司已完成了其在多发性骨髓瘤的首个人体I/II期临床试验,显示出非常好的安全性。FDA批准远大医药COVID-19疫苗项目CORVax12进行I期临床试验2020年11月3日,远大医药发布公告,集团在肿瘤免疫领域及DNA技术研发平台OncoSec Medical Incorporated(NASDAQ:ONCS)与Providence Cancer Institute(Providence)合作开发,针对新型冠状病毒COVID19的DNA疫苗CORVax12获得美国食品和药物管理局(FDA)的新药临床试验申请批准并启动研究者发起的I期临床试验。该疫苗是目前唯一使用免疫刺激剂来促进对SARS-CoV-2病毒免疫反应的DNA疫苗,旨在作为预防性疫苗预防COVID-19。生物技术公司Neuraly获得FDA批准,启动NLY01在阿尔茨海默病患者中的2B期试验2020年11月2日,临床阶段生物技术公司Neuraly, Inc.宣布该公司的新药研究申请(IND)已获得FDA批准,将启动NLY01在阿尔茨海默病患者中的2B期试验。在2020年2月启动的2期试验中,NLY01也在评估帕金森病患者。波士顿科学公司的Ranger™药物涂层球囊获得FDA批准2020年11月2日,波士顿科学公司宣布Ranger™药物涂层球囊已获得FDA批准,该球囊是为治疗股浅动脉(SFA)和近端腘动脉(PPA)的外周动脉疾病(PAD)患者而开发的。Ranger DCB采用低治疗药物剂量和专有涂层设计,可有效地将药物转移到组织中,从而为患者带来较高的初级通畅率和较低的全身药物暴露。FDA批准药物研发公司Pharmaxis的Bronchitol作为附加维持疗法,以改善囊性纤维化患者肺功能2020年11月2日获悉,FDA批准药物研发公司Pharmaxis的Bronchitol作为一种附加的维持疗法,以改善18岁及以上囊性纤维化(CF)患者的肺功能。Bronchitol通过便携式吸入器输送到肺部,通过给呼吸道/肺部表面补水,促进有效咳嗽。该批准是基于2017年在1020名囊性纤维化患者中完成的三项III期试验。这三项研究的主要疗效终点都是治疗26周后肺功能的改善。诺和诺德索马鲁肽治疗NASH获FDA突破性疗法认定2020年10月31日,诺和诺德(Novo Nordisk)公司索马鲁肽获FDA突破性疗法认定,用于治疗非酒精性脂肪性肝炎(NASH)患者。索马鲁肽作为单药疗法,在治疗NASH的2期临床试验中获得积极结果,与安慰剂相比,在不加剧肝脏纤维化的情况下,显著消除患者的NASH组织学症状。在接受最高剂量索马鲁肽治疗组的患者中,66.7%患者的NASH症状得到消除,安慰剂组这一数值为22.9%。
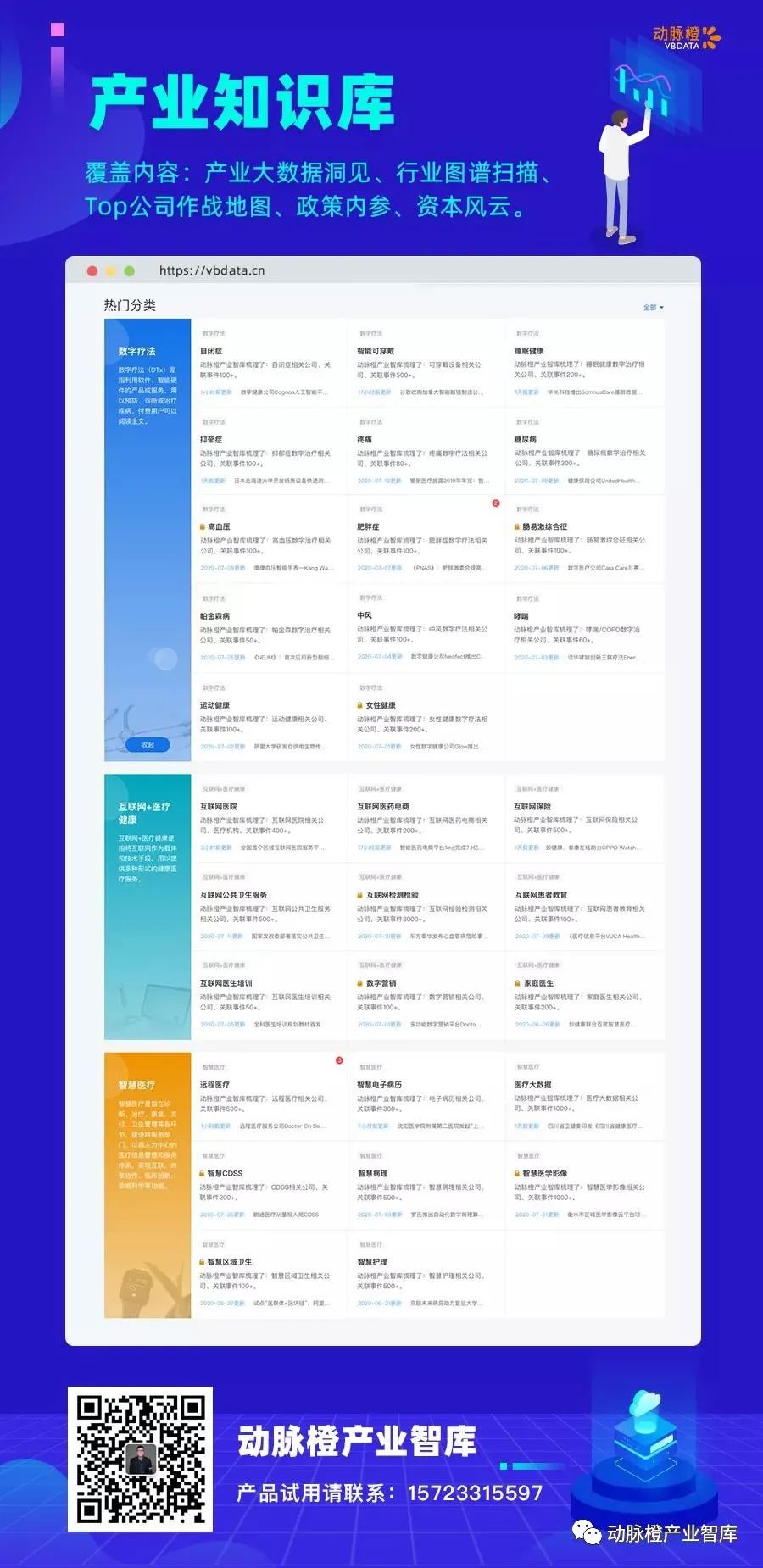
数字健康三大版块(数字疗法、互联网+医疗健康、智慧医疗)30+细分领域,将在动脉橙产业智库全部上线,并持续更新,欢迎长按下方海报识别添加微信联系试用。